En els experiments de qPCR, el disseny d'imprimació també és un enllaç molt important.Si els primers són adequats o no està estretament relacionat amb si l'eficiència d'amplificació arriba a l'estàndard, si els productes amplificats són específics i si els resultats experimentals estan disponibles.
Llavors, com millorar l'especificitat del primer qPCR?Alta eficiència d'amplificació?
Avui, us portarem a dissenyar els primers qPCR junts i deixarem que el disseny de les imprimacions qPCR es converteixi en una habilitat de coneixement eficient en experiments.
Quan es dissenyen els primers qPCR, normalment presteu atenció als punts següents: els primers s'han de dissenyar a través d'introns tant com sigui possible, la longitud del producte ha de ser de 100 a 300 pb, el valor de Tm ha d'estar el més proper possible als 60 ° C i els primers aigües amunt i aigües avall han d'estar el més a prop possible i el final de l'imprimació ha de ser G o C, etc.
1. Disseny de primers que abasten introns
Quan es dissenyen cebadors de qPCR, escollir cebadors dissenyats entre introns pot evitar que la plantilla d'ADNg s'amplifi i tots els productes es deriven de l'amplificació de l'ADNc, eliminant així la influència de la contaminació de l'ADNg.
2. Longitud de la imprimació
La longitud del cebador és generalment entre 18-30 nt, i la longitud del producte d'amplificació s'ha de controlar entre 100-300 pb tant com sigui possible.
Si el cebador és massa curt, donarà lloc a una amplificació inespecífica, i si és massa llarg, formarà fàcilment una estructura secundària (com l'estructura de forquilla).Si el producte d'amplificació és massa llarg, no és adequat per a la reacció de la polimerasa, cosa que afectarà l'eficiència de l'amplificació per PCR.
3. Contingut GC i valor Tm
El contingut de GC dels primers s'ha de controlar entre un 40% i un 60%.Si és massa alt o massa baix, no és propici per iniciar la reacció.El contingut de GC dels cebadors directes i inversos ha de ser proper al mateix per obtenir el mateix valor de Tm i la mateixa temperatura de recuit.
El valor de Tm ha d'estar entre 55 i 65 °C en la mesura del possible, generalment al voltant dels 60 °C, i el valor de Tm de l'aigua amunt i aigües avall ha d'estar el més proper possible, preferiblement no més de 4 °C.
4. Eviteu seleccionar A a l'extrem 3′ de la imprimació
Quan l'extrem 3' de l'imprimació no coincideix, hi ha grans diferències en l'eficiència de síntesi de diferents bases.Quan l'última base és A, també pot iniciar la síntesi de cadena fins i tot en el cas de desajustaments, i quan l'última base és T Quan , l'eficiència de la inducció de desajustaments es redueix molt.Per tant, intenteu evitar triar A a l'extrem 3′ de la imprimació, i és millor triar T.
Si es tracta d'un cebador de sonda, l'extrem 5' de la sonda no pot ser G, perquè fins i tot quan una sola base G està connectada al grup informador fluorescent FAM, G també pot apagar el senyal fluorescent emès pel grup FAM, donant lloc a resultats falsos negatius.Apareix.
5. Distribució base
La distribució de les quatre bases en el cebador és preferentment aleatòria, evitant més de 3 G o C consecutius a l'extrem 3′, i més de 3 consecutius.G o C són fàcils de generar aparellament a la regió de seqüència rica en GC.
6. La regió de disseny d'imprimació hauria d'evitar estructures secundàries complexes.
L'estructura secundària formada per la cadena única del producte d'amplificació afectarà el progrés suau de la PCR.En predir amb antelació si hi ha una estructura secundària a la seqüència diana, intenteu evitar aquesta regió en el disseny dels cebadors.
7. Els primers mateixos i entre els primers han d'intentar evitar bases complementàries consecutives.
No pot haver-hi una complementarietat consecutiva de 4 bases entre el propi imprimador i el cebador.L'imprimació en si no hauria de tenir una seqüència complementària, en cas contrari es plegarà per formar una estructura de forquilla, que afectarà la combinació de recuit de la imprimació i la plantilla.
No poden existir seqüències complementàries entre els cebadors aigües amunt i aigües avall.La complementarietat entre els primers produirà dímers d'imprimació, que reduiran l'eficiència de la PCR i fins i tot afectaran la precisió quantitativa.Si les estructures d'imprimació-dímer i forquilla són inevitables, el valor △G no hauria de ser massa alt (hauria de ser inferior a 4,5 kcal/mol).
8. Els primers amplifiquen el producte específic objectiu.
L'objectiu final de la detecció de qPCR és entendre l'abundància del gen objectiu.Si es produeix una amplificació inespecífica, la quantificació serà inexacta.Per tant, un cop dissenyats els cebadors, s'han de provar amb BLAST i l'especificitat dels productes es compara a la base de dades de seqüències.
A continuació, prenem el gen humà GAS6 (Growth stop specific 6) com a exemple per dissenyar primers qPCR.
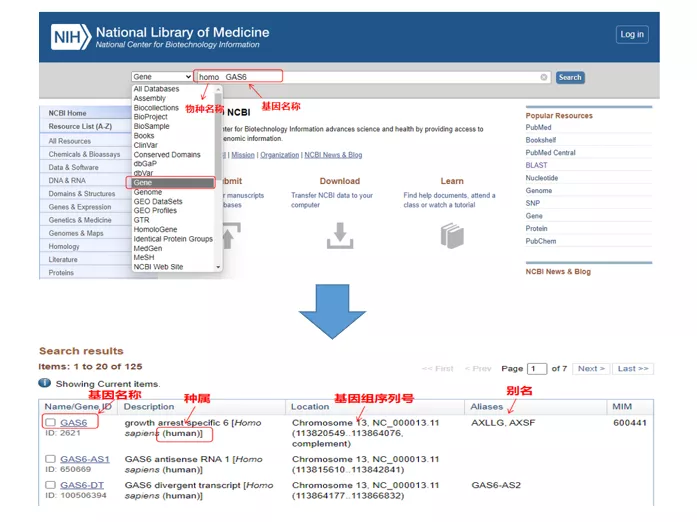
01 gen de consulta
Homo GAS6mitjançant NCBI.Aquí, hauríem de parar atenció a comparar el nom del gen i les espècies per assegurar-nos que siguin coherents.
 02 Trobeu la seqüència del gen
02 Trobeu la seqüència del gen
(1) Si la seqüència diana és ADN genòmic, seleccioneu la primera, que és la seqüència d'ADN genòmic del gen.
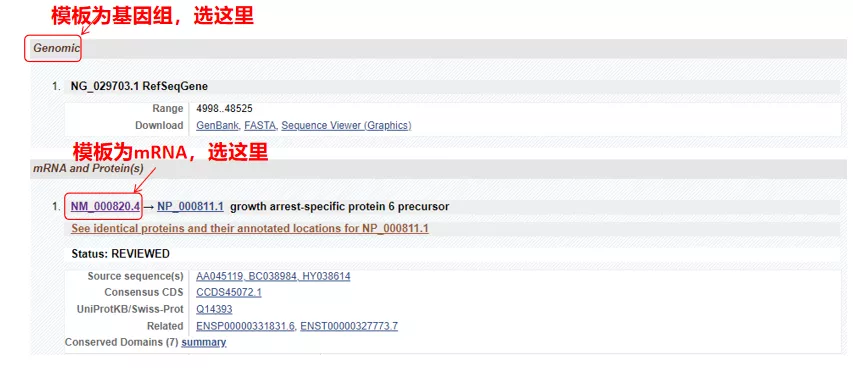 (2) Si la seqüència objectiu és l'ARNm, seleccioneu la segona.Després d'entrar, feu clic a "CDS" a la taula següent.La seqüència de fons marró és la seqüència codificant del gen.
(2) Si la seqüència objectiu és l'ARNm, seleccioneu la segona.Després d'entrar, feu clic a "CDS" a la taula següent.La seqüència de fons marró és la seqüència codificant del gen.
 03 Disseny d'imprimacions
03 Disseny d'imprimacions
Entra a la interfície Primer-BLAST
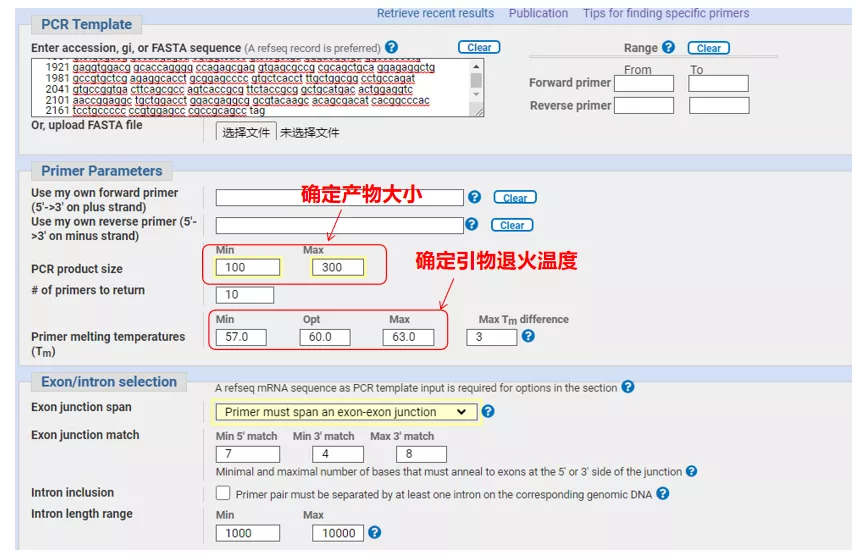
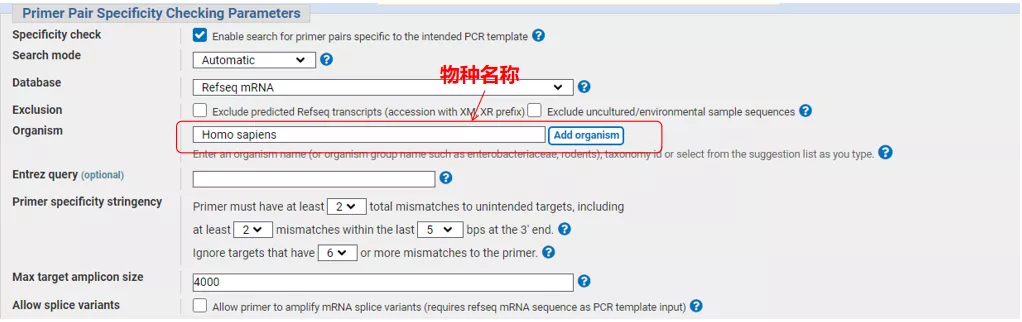
 Introduïu el número de seqüència del gen o la seqüència en format Fasta a la part superior esquerra i ompliu els paràmetres pertinents.
Introduïu el número de seqüència del gen o la seqüència en format Fasta a la part superior esquerra i ompliu els paràmetres pertinents.
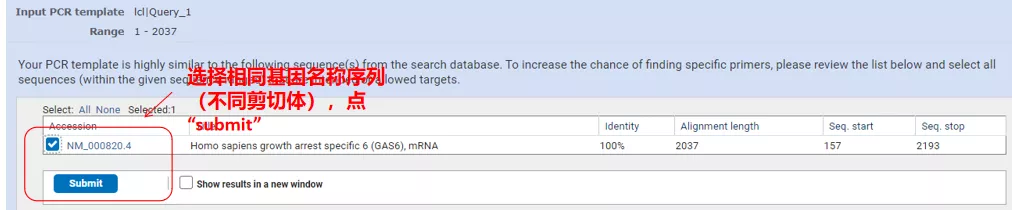
Feu clic a "Obtenir primers" i apareixerà NCBI per dir-vos que aquesta selecció de paràmetres s'amplificarà a altres variants d'empalmament.Podem comprovar les diferents variants d'empalmament i enviar-les per obtenir el parell d'imprimació adequat (com es mostra a la figura següent).Aquest procés pot trigar desenes de segons a executar-se.
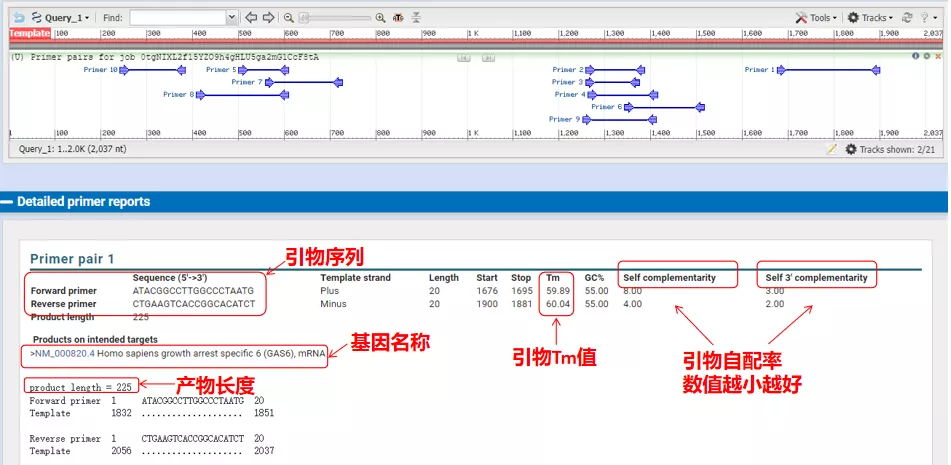 Les temperatures de recuit d'aquests parells d'imprimadors són al voltant dels 60 °C.Segons el propòsit de l'experiment, trieu primers amb una longitud moderada, bona especificitat i menys autocomplementació dels primers per a l'experiment, i la taxa d'èxit és bastant alta!
Les temperatures de recuit d'aquests parells d'imprimadors són al voltant dels 60 °C.Segons el propòsit de l'experiment, trieu primers amb una longitud moderada, bona especificitat i menys autocomplementació dels primers per a l'experiment, i la taxa d'èxit és bastant alta!
04 Verificació de l'especificitat de la imprimació
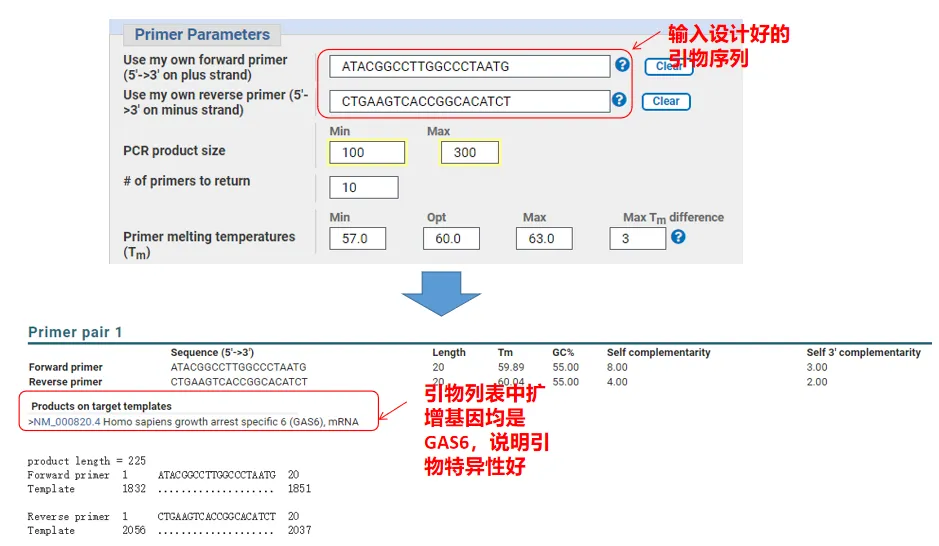
De fet, a més de dissenyar imprimacions, Primer-Blast també pot avaluar les imprimacions que hem dissenyat nosaltres mateixos.Torneu a la pàgina de disseny d'imprimació, introduïu els imprimadors aigües amunt i aigües avall que hem dissenyat i altres paràmetres no s'ajustaran.Després de l'enviament, podeu veure si el parell de primers també existeix en altres gens.Si tots ells es mostren al gen que volem amplificar, indicant que l'especificitat d'aquest parell de primers és fantàstica!(Per exemple, aquest és l'únic resultat de la consulta d'imprimació!)
05 Primer judici de qualitat
Quin tipus d'imprimació és l'imprimació "perfecta" que combina "eficiència d'amplificació fins a l'estàndard", "característiques del producte amplificades" i "resultats experimentals fiables"?
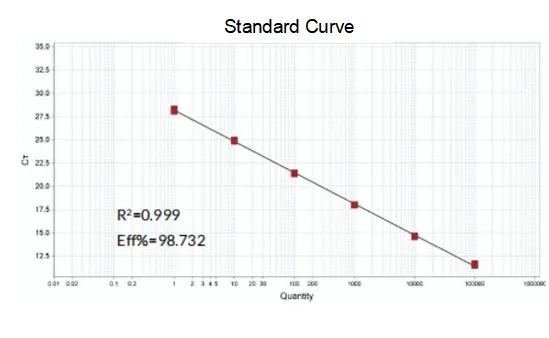 Eficiència d'amplificació
Eficiència d'amplificació
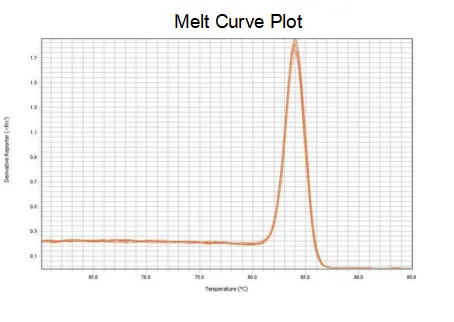 corba de fusió
corba de fusió
L'eficiència d'amplificació dels primers arriba al 90%-110%, la qual cosa significa que l'eficiència d'amplificació és bona i la corba de fusió té un sol pic i normalment Tm>80 °C, la qual cosa significa que l'especificitat d'amplificació és bona.
Productes relacionats:
Real Time PCR Easy–SYBR GREEN I
PCR en temps real Easy-Taqman
Hora de publicació: 10-feb-2023








