La PCR (reacció en cadena de la polimerasa) és una de les tecnologies d'amplificació d'ADN in vitro, amb una història de més de 30 anys.
La tecnologia PCR va ser pionera per Kary Mullis de Cetus, EUA el 1983. Mullis va sol·licitar una patent de PCR el 1985 i va publicar el primer article acadèmic de PCR sobre Science el mateix any.Mullis va rebre el Premi Nobel de Química l'any 1993 pel seu treball.
Principis bàsics de la PCR
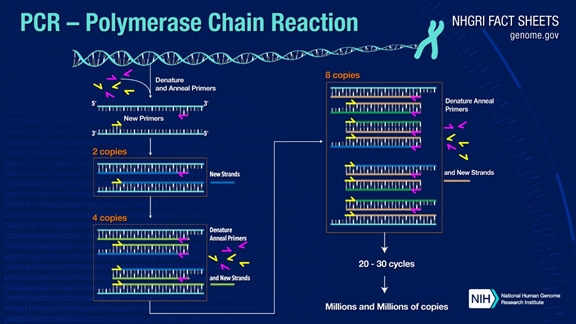
La PCR pot amplificar fragments d'ADN objectiu més d'un milió de vegades.El principi es troba sota la catàlisi de l'ADN polimerasa, utilitzant l'ADN de la cadena pare com a plantilla i un cebador específic com a punt de partida per a l'extensió.Es replica in vitro mitjançant passos com la desnaturalització, el recuit i l'extensió.El procés de l'ADN de la cadena filla complementari a l'ADN plantilla de la cadena mare.
El procés estàndard de PCR es divideix en tres passos:
1.Desnaturalització: utilitzar alta temperatura per separar les cadenes dobles d'ADN.L'enllaç d'hidrogen entre les cadenes dobles d'ADN es trenca a alta temperatura (93-98 ℃).
2.Recuit: Després de separar l'ADN de doble cadena, baixeu la temperatura perquè l'encebador es pugui unir a l'ADN monocatenari.
3.Extensió: L'ADN polimerasa comença a sintetitzar cadenes complementàries al llarg de les cadenes d'ADN a partir dels cebadors units quan la temperatura baixa.Quan es completa l'extensió, es completa un cicle i el nombre de fragments d'ADN es duplica
Al alternar aquests tres passos 25-35 vegades, el nombre de fragments d'ADN augmentarà exponencialment.
L'enginy de la PCR és que es poden dissenyar diferents cebadors per a diferents gens diana, de manera que els fragments del gen diana es poden amplificar en un curt període de temps.
Fins ara, la PCR es pot dividir en tres categories, a saber, PCR ordinària, PCR quantitativa fluorescent i PCR digital.
La primera generació de PCR ordinària
Utilitzeu un instrument d'amplificació PCR normal per amplificar el gen objectiu i, a continuació, utilitzeu l'electroforesi en gel d'agarosa per detectar el producte, només es pot fer una anàlisi qualitativa.
Els principals desavantatges de la PCR de primera generació:
1.Propens a l'amplificació inespecífica i a resultats falsos positius.
2.La detecció triga molt de temps i l'operació és feixuga.
3. Només es pot fer una prova qualitativa
PCR en temps real de segona generació
La PCR en temps real, també coneguda com qPCR, utilitza sondes fluorescents que poden indicar el progrés del sistema de reacció i controla l'acumulació de productes amplificats mitjançant l'acumulació de senyals fluorescents i jutja els resultats mitjançant la corba de fluorescència.Es pot quantificar amb l'ajuda del valor Cq i la corba estàndard.
Com que la tecnologia qPCR es porta a terme en un sistema tancat, la probabilitat de contaminació es redueix i el senyal de fluorescència es pot controlar per a la detecció quantitativa, de manera que és la més utilitzada en la pràctica clínica i s'ha convertit en la tecnologia dominant en PCR.
Les substàncies fluorescents utilitzades en la PCR quantitativa fluorescent en temps real es poden dividir en: sonda fluorescent TaqMan, balises moleculars i colorant fluorescent.
1) Sonda fluorescent TaqMan:
Durant l'amplificació per PCR, s'afegeix una sonda fluorescent específica mentre s'afegeix un parell d'imprimadors.La sonda és un oligonucleòtid, i els dos extrems estan marcats amb un grup fluorescent reporter i un grup fluorescent extintor.
Quan la sonda està intacta, el senyal fluorescent emès pel grup informador és absorbit pel grup d'extinció;durant l'amplificació per PCR, l'activitat de l'exonucleasa 5'-3' de l'enzim Taq escinda i degrada la sonda, fent que el grup fluorescent reporter i l'extinció. El grup fluorescent es separa, de manera que el sistema de monitorització de la fluorescència pot rebre el senyal de fluorescència, és a dir, cada vegada que s'amplifica una cadena d'ADN, es forma una fluorescència i la formació de fluorescència es sincronitza completament amb la molècula. el producte PCR.
2) Colorant fluorescent SYBR:
En el sistema de reacció PCR, s'afegeix un excés de colorant fluorescent SYBR.Després que el colorant fluorescent SYBR s'incorpori de manera no específica a la doble cadena d'ADN, emet un senyal fluorescent.La molècula de colorant SYBR que no s'incorpora a la cadena no emetrà cap senyal fluorescent, assegurant així el senyal fluorescent. L'augment de productes de PCR està completament sincronitzat amb l'augment de productes de PCR.SYBR només s'uneix a l'ADN de doble cadena, de manera que la corba de fusió es pot utilitzar per determinar si la reacció de PCR és específica.
3) Balisa molecular:
Es tracta d'una sonda d'oligonucleòtid de doble etiqueta amb bucle de tija que forma una estructura de forquilla d'unes 8 bases als extrems 5 i 3.Les seqüències d'àcids nucleics als dos extrems estan aparellades de manera complementària, fent que el grup fluorescent i el grup d'extinció estiguin ajustats.A prop, no es produirà cap fluorescència.
Després de generar el producte de PCR, durant el procés de recuit, la part mitjana de la balisa molecular s'aparella amb una seqüència d'ADN específica i el gen fluorescent es separa del gen quencher per produir fluorescència.
Els principals desavantatges de la PCR de segona generació:
Encara falta sensibilitat i la detecció d'exemplars de poca còpia és inexacta.
Hi ha la influència del valor de fons i el resultat és susceptible d'interferències.
Quan hi ha inhibidors de la PCR al sistema de reacció, els resultats de la detecció són susceptibles a interferències.
PCR digital de tercera generació
La PCR digital (DigitalPCR, dPCR, Dig-PCR) calcula el número de còpia de la seqüència objectiu mitjançant la detecció del punt final i pot realitzar una detecció quantitativa absoluta precisa sense utilitzar controls interns i corbes estàndard.
La PCR digital utilitza la detecció del punt final i no depèn del valor Ct (llindar del cicle), de manera que la reacció de PCR digital es veu menys afectada per l'eficiència d'amplificació i es millora la tolerància als inhibidors de la reacció de PCR, amb una alta precisió i reproductibilitat.
A causa de les característiques d'alta sensibilitat i alta precisió, els inhibidors de la reacció de PCR no interfereixen fàcilment i pot aconseguir una quantificació absoluta sense productes estàndard, que s'ha convertit en un punt d'investigació i aplicació.
Segons les diferents formes de la unitat de reacció, es pot dividir en tres tipus principals: sistemes microfluídics, xips i gotes.
1) PCR digital microfluídica, mdPCR:
A partir de la tecnologia microfluídica, la plantilla d'ADN es separa.La tecnologia microfluídica pot realitzar la nano-actualització de la mostra o la generació de gotes més petites, però les gotes necessiten un mètode d'adsorció especial i després es combinen amb el sistema de reacció PCR.mdPCR s'ha anat adoptant gradualment per altres mètodes de substitució.
2) PCR digital basada en gotes, ddPCR:
Utilitzeu la tecnologia de generació de gotetes d'aigua en oli per processar la mostra en gotetes i dividiu el sistema de reacció que conté molècules d'àcid nucleic en milers de gotetes a nanoescala, cadascuna de les quals no conté la molècula diana d'àcid nucleic a detectar, o conté una o diverses molècules diana d'àcid nucleic per provar.
3) PCR digital basada en xip, cdPCR:
Utilitzeu la tecnologia integrada de la ruta de fluids per gravar molts microtubs i microcavitats en hòsties de silici o vidre de quars, i controlar el flux de la solució a través de diferents vàlvules de control i dividir el líquid de la mostra en nanòmetres de la mateixa mida als pous de reacció per a la reacció PCR digital per aconseguir la quantificació absoluta.
Els principals desavantatges de la PCR de tercera generació:
L'equip i els reactius són cars.
Els requisits de qualitat de la plantilla són alts.Si la quantitat de plantilla supera la quantitat del microsistema, serà impossible de quantificar, i si és massa petita, la precisió de quantificació es reduirà.
També es poden generar falsos positius quan hi ha una amplificació inespecífica.
Hora de publicació: 30-jul-2021