Material de partida: ARN
La PCR de transcripció inversa quantitativa (RT-qPCR) és un mètode experimental utilitzat en experiments de PCR amb ARN com a material de partida.En aquest mètode, l'ARN total o ARN missatger (ARNm) es transcriu primer a ADN complementari (ADNc) per transcriptasa inversa.Posteriorment, es va realitzar una reacció qPCR utilitzant l'ADNc com a plantilla.La RT-qPCR s'ha utilitzat en una varietat d'aplicacions de biologia molecular, com ara l'anàlisi d'expressió gènica, la validació d'interferències d'ARN, la validació de microarrays, la detecció de patògens, les proves genètiques i la investigació de malalties.
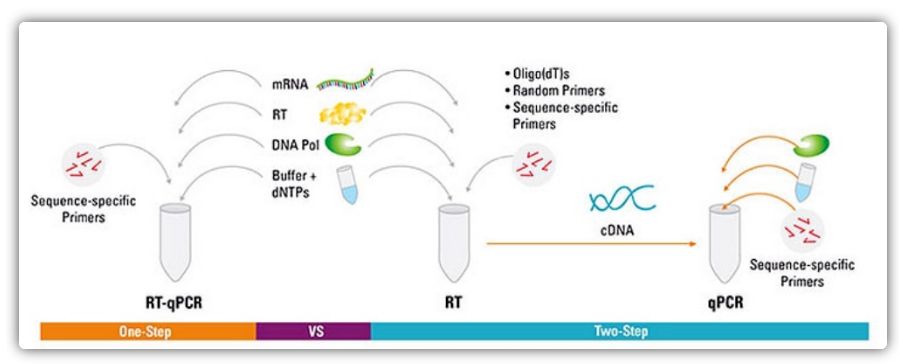
Mètodes d'un i dos passos per a RT-qPCR
La RT-qPCR es pot aconseguir mitjançant un mètode d'un o dos passos.La RT-qPCR d'un sol pas combina la transcripció inversa i l'amplificació per PCR, permetent que la transcriptasa inversa i l'ADN polimerasa completin la reacció al mateix tub en les mateixes condicions de tampó.La RT-qPCR d'un sol pas només requereix l'ús d'encebadors específics de la seqüència.En RT-qPCR en dos passos, la transcripció inversa i l'amplificació per PCR es realitzen en dos tubs, utilitzant diferents tampons optimitzats, condicions de reacció i estratègies de disseny d'imprimació.
| Avantatge | Desavantatge | |
| Un pas | Aquest mètode té menys error experimental, ja que ambdues reaccions es fan en un tub
Menys passos de pipeta redueixen el risc de contaminació
Apte per a l'amplificació/detecció d'alt rendiment, ràpid i reproduïble | Les reaccions en dos passos no es poden optimitzar per separat
Atès que les condicions de reacció es veuen compromeses combinant la reacció de dos passos, la sensibilitat no és tan bona com la del mètode de dos passos
El nombre d'objectius detectats per una sola mostra és petit |
| Dos passos | Capacitat de crear biblioteques d'ADNc estables que es poden emmagatzemar durant llargs períodes de temps i utilitzar-se en múltiples reaccions
Els gens objectiu i els gens de referència es poden amplificar des de la mateixa biblioteca d'ADNc sense necessitat de múltiples biblioteques d'ADNc
Tampons de reacció i condicions de reacció que permeten l'optimització d'execucions de reacció única
Selecció flexible de les condicions d'activació | L'ús de diversos tubs i més passos de pipeta augmenta el risc de contaminació de l'ADN, i consumeix temps.
Requereix més optimització que el mètode d'un sol pas |
Productes relacionats:
RT-qPCR Easyᵀᴹ (One Step)-SYBR Green I
RT-qPCR Easyᵀᴹ (Un pas)-Taqman
RT Easyᵀᴹ I Master Premix per a la síntesi de CDNA de primera cadena
Kit PCR en temps real Easyᵀᴹ-SYBR Green I
PCR en temps real Easyᵀᴹ-Taqman
Selecció d'ARN total i ARNm
Quan es dissenya un experiment de RT-qPCR, és important decidir si s'utilitza ARN total o ARNm purificat com a plantilla per a la transcripció inversa.Tot i que l'ARNm pot proporcionar una sensibilitat lleugerament superior, l'ARN total encara s'utilitza amb freqüència.La raó d'això és que l'ARN total té un avantatge més important com a material de partida que l'ARNm.En primer lloc, el procés requereix menys passos de purificació, cosa que garanteix una millor recuperació quantitativa de la plantilla i una millor normalització dels resultats als números de cèl·lules inicials.En segon lloc, evita el pas d'enriquiment de l'ARNm, que pot evitar la possibilitat de resultats esbiaixats a causa de diferents recuperacions de diferents ARNm.En general, com que en la majoria de les aplicacions la quantificació relativa del gen objectiu és més important que la sensibilitat absoluta de la detecció, l'ARN total és més adequat en la majoria dels casos.
Imprimador de transcripció inversa
En el mètode de dos passos, es poden utilitzar tres mètodes diferents per cebar la reacció d'ADNc: cebadors oligo(dT), cebadors aleatoris o cebadors específics de la seqüència.Normalment, els cebadors oligo(dT) i els cebadors aleatoris s'utilitzen en combinació.Aquests cebadors s'apropen a la cadena d'ARNm de plantilla i proporcionen transcriptasa inversa amb un punt de partida per a la síntesi.
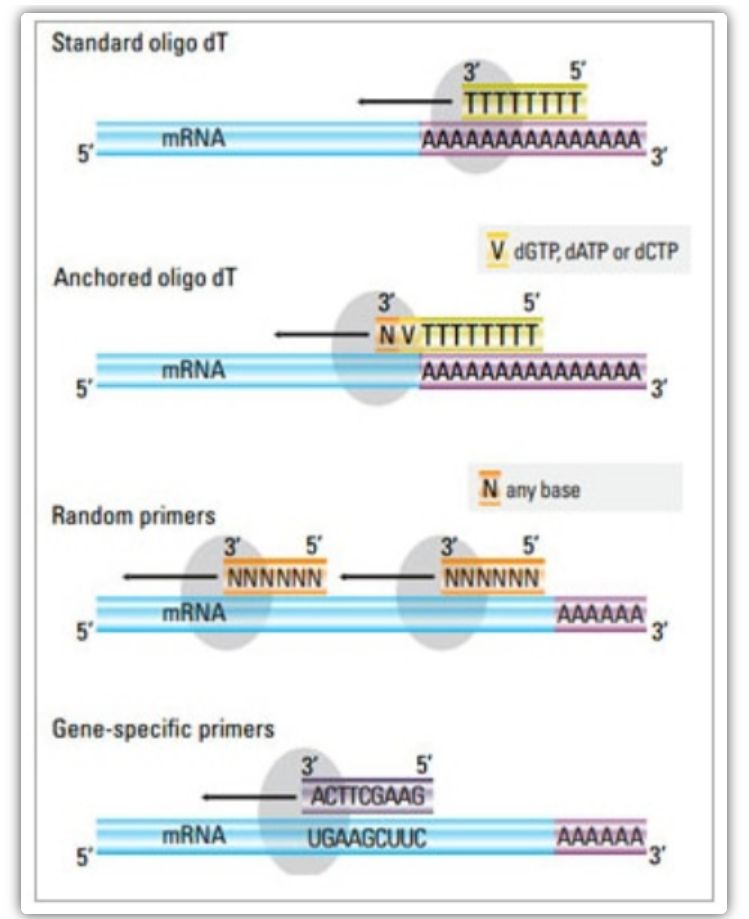
| Selecció de primers | Estructura i funció | Avantatge | Desavantatge |
| Imprimació oligo(dT) (o imprimació oligo(dT) ancorada) | Recuit estès als residus de timina a la cua poli(A) de l'ARNm;Oligo(dT) d'ancoratge conté un G, C o A a l'extrem 3' (lloc d'ancoratge) | Síntesi d'ADNc de longitud completa a partir d'ARNm de cua poli(A).
Aplicable quan hi ha menys material de partida disponible
El lloc d'ancoratge garanteix que l'encebador oligo(dT) s'uneixi a la cua poli(A) 5' de l'ARNm | Només apte per amplificar gens amb cues poli(A).
Obteniu l'ADNc truncat del lloc d'encebació * 2 en poli (A)
Esbiaixat per unir-se a l'extrem 3'*
*Aquesta possibilitat es minimitza si s'utilitzen imprimadors oligo(dT) ancorats |
| imprimació aleatòria
| De 6 a 9 bases de longitud, que es poden recuit a múltiples llocs durant la transcripció de l'ARN | Recuperació de tots els ARN (ARNt, ARNr i ARNm)
Adequat per a transcripcions amb una estructura secundària significativa o quan hi ha menys material de partida disponible
Alt rendiment d'ADNc | L'ADNc es transcriu inversament de tot l'ARN, cosa que normalment no es desitja i pot diluir el senyal de l'ARNm objectiu.
obtenir ADNc truncat |
| cebadors específics de la seqüència | Cebadors personalitzats dirigits a seqüències específiques d'ARNm | biblioteca d'ADNc específica
Millorar la sensibilitat
Utilitzant primers de qPCR inversa | Només es limita a la síntesi d'un sol gen objectiu |
Transcriptasa inversa
La transcriptasa inversa és un enzim que utilitza ARN per sintetitzar DNA.Algunes transcriptases inverses tenen activitat RNasa i poden degradar cadenes d'ARN en cadenes híbrides ARN-ADN després de la transcripció.Si no té activitat enzimàtica RNasa, es pot afegir RNasaH per a una major eficiència de qPCR.Els enzims que s'utilitzen habitualment inclouen la transcriptasa inversa del virus de la leucèmia murina Moloney i la transcriptasa inversa del virus del mieloblastoma aviari.Per a la RT-qPCR, és ideal triar una transcriptasa inversa amb una termoestabilitat més alta, de manera que la síntesi d'ADNc es pugui realitzar a temperatures més altes, garantint una transcripció exitosa d'ARN amb una estructura secundària més alta, alhora que es manté la seva activitat completa durant tota la reacció, donant lloc a rendiments més elevats d'ADNc.
Productes relacionats:
Transcriptasa inversa Foreasy M-MLV
Activitat RNasa H de la transcriptasa inversa
RNaseH és capaç de degradar les cadenes d'ARN dels dúplex ARN-ADN, permetent una síntesi eficient d'ADN de doble cadena.Tanmateix, quan s'utilitza ARNm llarg com a plantilla, l'ARN es pot degradar prematurament, donant lloc a un ADNc truncat.Per tant, sovint és beneficiós minimitzar l'activitat de RNasaH durant la clonació d'ADNc si es desitja la síntesi de transcripcions llargues.En canvi, les transcriptases inverses amb activitat RNasa H sovint són beneficioses per a aplicacions de qPCR perquè milloren la fusió dels dúplex ARN-ADN durant el primer cicle de PCR.
Disseny d'imprimació
Els cebadors de PCR utilitzats per al pas de qPCR a RT-qPCR haurien de dissenyar-se idealment per abastar una unió exó-exó, on un cebador d'amplificació podria abastar un límit real exó-intró.Com que les seqüències d'ADN genòmic que contenen introns no s'amplifiquen, aquest disseny redueix el risc d'amplificació de falsos positius per contaminar l'ADN genòmic.
Si els cebadors no es poden dissenyar per separar exons o límits exó-exó, pot ser necessari tractar mostres d'ARN amb DNasa I o dsDNasa lliure de RNasa per eliminar la contaminació de l'ADN genòmic.
Control RT-qPCR
S'ha d'incloure un control negatiu de transcripció inversa (control -RT) en tots els experiments de RT-qPCR per detectar la contaminació d'ADN (com ara l'ADN genòmic o els productes de PCR de reaccions anteriors).Aquest control conté tots els components de la reacció excepte la transcriptasa inversa.Com que la transcripció inversa no es produeix amb aquest control, si s'observa una amplificació per PCR, és més probable la contaminació per ADN.
Hora de publicació: 02-agost-2022








