Com a nou al laboratori, no és un bon treball eliminar les plantes positives d'un munt de plantes amb una taxa de conversió baixa.En primer lloc, s'ha d'extreure l'ADN d'un gran nombre de mostres una per una, i després es detectaran els gens estrangers per PCR.Tanmateix, els resultats sovint són espais en blanc i bandes amb alguns elements ocasionalment, però és impossible determinar si hi ha deteccions falses o falses..És molt impotent afrontar aquest procés i resultats experimentals?No us preocupeu, el germà us ensenya a eliminar les plantes positives transgèniques de manera fàcil i precisa.
Pas 1
Disseny de primers de detecció
Determineu el gen endògen i el gen exogen que s'ha de detectar segons la mostra que s'ha de provar i seleccioneu una seqüència representativa de 100-500 pb en el gen per al disseny d'imprimació.Els bons cebadors poden garantir la precisió dels resultats de la detecció i escurçar el temps de detecció (vegeu l'apèndix per als primers de detecció d'ús habitual).
Avís: els primers dissenyats recentment han d'optimitzar les condicions de reacció i verificar la precisió, la precisió i el límit de detecció de la detecció abans de la detecció a gran escala.
Pas 2
Disseny del protocol experimental
Control positiu: utilitzeu l'ADN purificat que conté el fragment diana com a plantilla per determinar si el sistema i les condicions de reacció de PCR són normals.
Control negatiu/blanc: utilitzeu la plantilla d'ADN o ddH2O que no conté el fragment diana com a plantilla per detectar si hi ha una font de contaminació al sistema de PCR.
Control intern de referència: utilitzar la combinació cebador/sonda del gen endògen de la mostra a provar per avaluar si la plantilla es pot detectar per PCR.
Avís:
S'han d'establir controls positius, negatius/en blanc i controls de control intern per a cada prova per avaluar la validesa dels resultats experimentals.
Preparació d'experiments
Abans d'utilitzar, observeu si la solució es barreja uniformement.Si es troba precipitació, s'ha de dissoldre i barrejar segons les instruccions abans d'utilitzar-la.La barreja de 2 × PCR s'ha de pipetar i barrejar repetidament amb una micropipeta abans d'utilitzar-la per evitar una distribució desigual d'ions.
Avís:
Traieu el manual i llegiu-lo amb atenció i feu els preparatius abans de l'experiment d'acord amb els requisits del manual.
Pas 4
Preparar el sistema de reacció de PCR
Segons el protocol experimental, barregeu uniformement els primers, H2O i 2 × PCR, centrifugueu-los i distribuïu-los a cada tub de reacció.
Avís:
Per a proves a gran escala o a llarg termini, es recomana utilitzar un sistema de reacció de PCR que contingui enzim UNG, que pot evitar eficaçment la contaminació d'aerosols causada pels productes de PCR.
Pas 5
Afegeix una plantilla de reacció
Mitjançant la tecnologia de PCR directa, no cal un procés de purificació d'àcid nucleic tediós, la plantilla de mostra es pot preparar en 10 minuts i es pot afegir el sistema de reacció PCR corresponent.
Avís:
El mètode d'escissió té un millor efecte de detecció i el producte obtingut es pot utilitzar per a múltiples reaccions de detecció.
5.1: Expansió directa de les fulles
Segons la mida de la imatge del manual, talleu el teixit de la fulla amb un diàmetre de 2-3 mm i col·loqueu-lo al sistema de reacció de PCR.
Nota: Assegureu-vos que els fragments de fulla estiguin completament immersos a la solució de reacció de PCR i no afegiu teixit de fulla excessiu.
5.2: Mètode de separació de fulles
Talleu el teixit de la fulla amb un diàmetre de 5-7 mm i col·loqueu-lo en un tub de centrífuga.Si trieu fulles madures, eviteu utilitzar els teixits de la vena principal de la fulla.Pipeteu 50ul Buffer P1 lisat en un tub de centrífuga per assegurar-vos que el lisat pugui submergir completament el teixit de la fulla, col·loqueu-lo en un termociclador o un bany metàl·lic i liseu a 95 ° C durant 5-10 minuts.
Afegiu 50 ul de solució de neutralització Buffer P2 i barregeu bé.El lisat resultant es pot utilitzar com a plantilla i afegir-lo al sistema de reacció de PCR.
Nota: La quantitat de plantilla està entre el 5 i el 10% del sistema de PCR i no ha de superar el 20% (per exemple, en un sistema de PCR de 20 μl, afegiu 1-2 μl de solució de lisi, no més de 4 μl).
Pas 6
Reacció de PCR
Després de centrifugar el tub de reacció de PCR, es col·loca en un instrument de PCR per a l'amplificació.
Avís:
La reacció utilitza una plantilla no purificada per a l'amplificació, de manera que el nombre de cicles d'amplificació és de 5-10 cicles més que quan s'utilitza una plantilla d'ADN purificat.
Pas 7
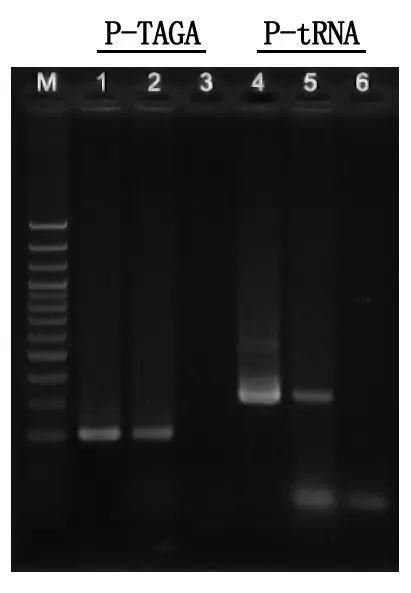
Detecció d'electroforesi i anàlisi de resultats
M: Escala d'ADN de 100 pb
1\4: Mètode d'ADN purificat
2\5: mètode de PCR directe
3\6: control en blanc
QC:
Els resultats de les proves dels diferents controls establerts a l'experiment haurien de complir les condicions següents.En cas contrari, s'hauria d'analitzar la causa del problema i la prova s'hauria de tornar a realitzar un cop eliminat el problema.
Taula 1. Resultats normals de les proves de diversos grups control
*Quan el plasmidi s'utilitza com a control positiu, el resultat de la prova del gen endògen pot ser negatiu
Judici de resultat:
A. El resultat de la prova del gen endògen de la mostra és negatiu, cosa que indica que l'ADN adequat per a la detecció de PCR ordinària no es pot extreure de la mostra o que l'ADN extret conté inhibidors de la reacció de la PCR, i l'ADN s'ha d'extreure de nou.
B. El resultat de la prova del gen endogen de la mostra és positiu i el resultat de la prova del gen exògen és negatiu, cosa que indica que s'extreu de la mostra ADN adequat per a la detecció de PCR ordinària i es pot jutjar que el gen XXX no es detecta a la mostra.
C. El resultat de la prova del gen endogen de la mostra és positiu i el resultat de la prova del gen exògen és positiu, cosa que indica que s'ha extret ADN adequat per a la detecció de PCR ordinària de la mostra i que l'ADN de la mostra conté el gen XXX.Es poden dur a terme més experiments de confirmació.
Pas 8
Disseny de primers de detecció
Després de l'experiment, utilitzeu una solució d'hipoclorit de sodi al 2% i una solució d'etanol al 70% per netejar l'àrea experimental per evitar la contaminació ambiental.
Hora de publicació: 08-set-2021